 Le prix Nobel de chimie vient d’être attribué à 3 chimistes, Prof. Richard F. Heck (Américain, Professeur émérite de l'Université du Delaware), Prof. Ei-Ichi Negishi (Japonais, Professeur de l'Université de Purdue) et Prof. Akira Suzuki (Japonais, Professeur de l'Université d'Hokkaido), pour leurs travaux sur les réactions catalysées par le palladium. Ces réactions ont trouvé de multiples applications dans tous les domaines de la chimie organique et leurs utilisations ont permis l’évolution d’un grand nombre de domaines aussi divers et variés que l’électronique, les matières plastiques ou encore la synthèse de molécules à visée thérapeutique. Cette décision n’est pas une surprise pour l’ensemble des chimistes qui attendaient impatiemment la reconnaissance des travaux sur le palladium. Il était même surprenant que les travaux sur la métathèse soient primés avant les travaux sur le palladium.
Le prix Nobel de chimie vient d’être attribué à 3 chimistes, Prof. Richard F. Heck (Américain, Professeur émérite de l'Université du Delaware), Prof. Ei-Ichi Negishi (Japonais, Professeur de l'Université de Purdue) et Prof. Akira Suzuki (Japonais, Professeur de l'Université d'Hokkaido), pour leurs travaux sur les réactions catalysées par le palladium. Ces réactions ont trouvé de multiples applications dans tous les domaines de la chimie organique et leurs utilisations ont permis l’évolution d’un grand nombre de domaines aussi divers et variés que l’électronique, les matières plastiques ou encore la synthèse de molécules à visée thérapeutique. Cette décision n’est pas une surprise pour l’ensemble des chimistes qui attendaient impatiemment la reconnaissance des travaux sur le palladium. Il était même surprenant que les travaux sur la métathèse soient primés avant les travaux sur le palladium.En 10 ans, c’est la 3ème fois que le prix Nobel de chimie est attribué à des spécialistes de la catalyse (2001 catalyse énantiosélective, 2005 métathèse et 2010 réactions palladocatalysées). Essayons de comprendre ce qu’est vraiment la catalyse.
La cata... quoi ?
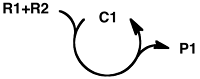
Pour faire simple, la catalyse est une branche de la chimie (essentiellement chimie organique mais pas seulement) qui s’intéresse à l’étude des réactions mettant en jeu un catalyseur. Une espèce chimique est appelée catalyseur lorsqu’elle permet l’accélération ou la faisabilité d’un processus (ou réaction) chimique et que ce composé reste inchangé en fin de réaction. Ce dernier point est très important : si la substance est détruite au cours de la réaction alors ce n’est pas un catalyseur !

Le catalyseur revenant à son état initial en fin de réaction, on peut très bien imaginer le réutiliser pour reproduire la même réaction ou une réaction du même type. Il est donc tout à fait imaginable de recycler les catalyseurs. Il est plus facile de recycler un catalyseur hétérogène qu'un catalyseur homogène. Ces deux termes se réfèrent à la solubilité du catalyseur dans la solution réactionnelle. Un catalyseur hétérogène n'est pas soluble (le poivre dans la soupe) alors que le catalyseur homogène est soluble (le sel dans la soupe). Lorsque les réactions utilisent des catalyseurs hétérogènes, il suffit de le filtrer pour le récupérer.
Mais on peut même faire mieux que cela. Idéalement si l'on place juste quelques traces de ce catalyseur dans une solution alors il permettra à la réaction d'avoir lieu une première fois mais rien ne l’empêchera de le faire une seconde fois, puis une troisième et ainsi de suite jusqu'à ce que tous les réactifs soient intégralement consommés. On parle alors de quantité catalytique. Ainsi nous nous retrouvons avec une espèce chimique qui peut être recyclée et qui idéalement peut être utilisée en très faible quantité afin de produire de nouvelles molécules plus complexes que les réactifs.
Les méthodes récompensées permettent ainsi la formation de liaisons entre les atomes de carbone. Par ailleurs, ces travaux ont permis l’émergence des réactions de couplage catalysées par un très grand nombre de métaux. On utilise aujourd’hui des métaux tels que le cuivre, le fer, le magnésium qui sont beaucoup moins chers et moins polluants que le palladium mais il faut bien garder à l’esprit que rien de cela n’aurait été possible sans les découvertes de ces 3 chimistes. A ce jour, les méthodes au palladium restent les plus fiables et les plus reproductibles même si quelques alternatives commencent à voir le jour.
Le pot catalytique
 Une application quotidienne de ce domaine réside dans l'utilisation de pot catalytique dans les voitures. Un des plus grands problèmes du moteur à explosion est qu'il ne permet pas une combustion complète de l'essence. De ce fait certaines quantités d'hydrocarbure et de monoxyde de carbone sont libérées dans l'atmosphère en plus du CO2. Ces pots d'échappement permettent de limiter les rejets de produits d'une combustion incomplète de l'essence. Ainsi en introduisant des métaux tels que le platine, le palladium, et le rhodium (généralement déposés sur une céramique), il est possible de rendre les gaz d'échappement moins nocifs (ne mettez quand même pas votre nez derrière un pot catalytique).
Une application quotidienne de ce domaine réside dans l'utilisation de pot catalytique dans les voitures. Un des plus grands problèmes du moteur à explosion est qu'il ne permet pas une combustion complète de l'essence. De ce fait certaines quantités d'hydrocarbure et de monoxyde de carbone sont libérées dans l'atmosphère en plus du CO2. Ces pots d'échappement permettent de limiter les rejets de produits d'une combustion incomplète de l'essence. Ainsi en introduisant des métaux tels que le platine, le palladium, et le rhodium (généralement déposés sur une céramique), il est possible de rendre les gaz d'échappement moins nocifs (ne mettez quand même pas votre nez derrière un pot catalytique).L'utilisation de catalyseur permet non seulement la faisabilité de ces réactions mais aussi de garder le pot pendant plusieurs années puisque les catalyseurs restent inchangés au cours de la réaction chimique. Ainsi votre voiture libère plus de CO2 mais c'est mieux que de libérer du monoxyde de carbone et du monoxyde d'azote dont l'influence sur l'effet de serre est beaucoup plus importante.
En conclusion, les catalyseurs, c'est un peu comme le fouet électrique pour monter les œufs en neige... C'est quand même beaucoup moins fastidieux et beaucoup plus rapide si vous l'utilisez. En plus il est utilisable pour plusieurs types de préparation.
Pour aller plus loin dans la catalyse








1 commentaires:
The Best Football Videos | YouTube
YouTube - Football youtube mp3 videos and streams of the top video game The best football videos, live streamers, video gf videos, videos, videos, videos,
Enregistrer un commentaire